Holland发现热稳定DNA聚合酶Taq在具有5→3方向的聚合酶活性的同时,还具有对聚合延伸过程中遇到的与靶序列结合的核苷酸序列的5→3核酸外切酶活性。1996年Heid将之前研究发现的Taq酶的5核酸外切酶活性与荧光共振能量转移(fluorescence resonance energy transfer,FRET)探针的概念结合起来,提出了使用Taqman探针进行qPCR的方法。
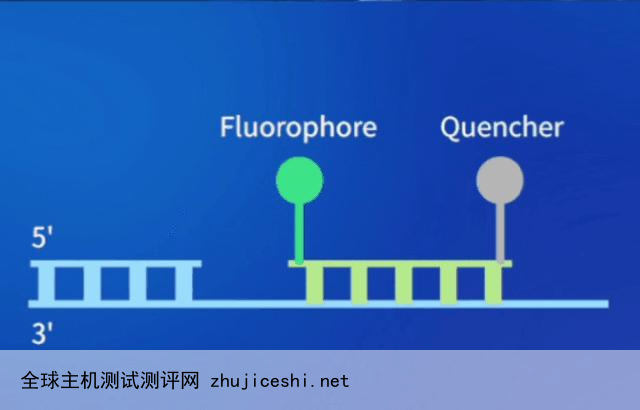
Taqman探针本质是FRET寡核苷酸探针,5端标记荧光染料报告基团(Fluorophore),3端标记淬灭基团(Quencher)。
TaqMan探针法qPCR的原理
TaqMan探针法qPCR即实时荧光定量PCR探针法的原理,如下图所示:在PCR扩增体系中加入扩增引物对的同时加入与目的序列匹配的特异性Taqman荧光探针,探针完整时,报告基团发射的荧光信号被淬灭基团吸收,随着反应的进行,Taq酶的5→3外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,荧光信号被从而荧光监测系统接收,即每扩增一个DNA分子,就有一个荧光分子形成,荧光强度与结合探针的DNA总量成正比。
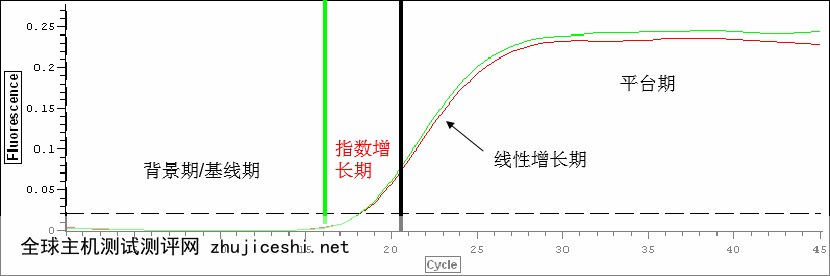
基于上述荧光PCR的原理,使用实时荧光PCR仪实时检测荧光信号,根据荧光信号与扩增循环数之间的关系,系统可自动计算出实时扩增曲线。图中基线(baseline)是指荧光信号积累但低于测定限之下的PCR循环,通常将基线设为3~15循环时的荧光信号。阈值是计算机根据基线的变化所任意选择的,是指3~15个循环的基线荧光信号均值标准差的10倍。高于阈值的荧光信号是真实信号,用于定义样本阈值循环数,Ct是指荧光强度大于最小检测水平(即荧光阈值)时的PCR循环数,它是实时PCR的基本参数,也是获得准确且重现性好的数据的基础。
TaqMan 探针的应用
科学研究应用
使用TaqMan探针法进行实时荧光定量 PCR,可以用于微生物群落特性研究、家禽病毒感染检测、植物基因鉴定、水产渔业,转基因检测、遗传学分析等方面,其中对于突变体检测方面,TaqMan探针具有重要作用,可以设计两种不同荧光信号的探针,一个检测野生型,一个检测突变体,根据采集的荧光信号不同区分SNP位点;对于一些低表达量基因的检测、突变基因以及基因特定转录本的检测,TaqMan探针法相对于染料法的准确性和灵敏度上都更有优势。
医药卫生方面的应用
TaqMan 探针法可在医药卫生领域用于病源体检测,传染病检测,微小残留病变检测等等方面,该技术对病原体的基因水平检测解决了免疫学检测病程晚的问题,可尽早判断疾病感染的状态,适用于传染病早期的大规模确诊。
基因检测方面的应用
癌症发生,一般是由于相关基因发生突变引起的,TaqMan探针法一种有效的肿瘤前期检测及伴随诊断技术,可以有效地检测到基因的突变,并且能够精确定量基因表达水平,可进行单管多基因Taqman探针法检测,提高检测通量,降低检测成本,降低样本量需求。
TaqMan探针法优点
特异性强
探针法qPCR要达到检测的目的,不仅要上下游引物要跟模板匹配,还需要探针与模板匹配,提升了检测的特异性。另外一方面,对于模板同源性比较高的不同目的基因的检测和鉴定,在扩增引物特异性没法保证的情况下,可通过设计探针的特异性来达到特异性检测的目的。而且特异性的探针比特异性的引物对模板序列的特异性要求要低,只要模板有几个碱基甚至1个碱基的差异就能设计特异性的探针,而这对于扩增引物是无法实现的。
准确性、灵敏度高
从探针法qPCR原理来看,扩增引物和探针序列都匹配后扩增的产物才能产生荧光信号,这样就确保了荧光信号是目的片段的扩增产生的,排除了非特异性扩增的影响,检测结果所见即所得,从而保证了检测的准确性。特别是针对一些低拷贝和低浓度的样品,染料法qPCR随着循环数的增加容易出现引物二聚体的信号干扰,导致检测结果不准,而这种情况在探针法qPCR上不存在,因为即使出现引物二聚体,由于其不是目的片段,没有探针结合位点,所以也不会产生荧光信号。这也体现了探针法qPCR检测低拷贝样品的高准确性和高灵敏度。
可进行多重检测
在探针的5端标记不同的荧光修饰,则不同的探针在检测过程中就会发出不同的荧光信号。根据此原理,可以将检测不同目的基因或者基因型的探针标记不同的荧光修饰,用做混合检测,这样就可以做多重检测,检测对应的荧光信号就是检测对应探针的荧光定量结果,多重检测大大节省检测成本和检测时间,进一步提高了检测的速度和适用性。
TaqMan探针设计原则
●长度
建议15~30 bp (MGB探针长度在13~25 bp),以保证结合特异性;扩增子长度应小于150 bp。
●Tm值
68~72°C,高于引物8~10°C,可保证探针在退火时先于引物与目的片段结合,最好富含GC或使用MGB探针(MGB为小沟结合物,可提高退火温度)。
●5端与3端
探针5端避免为G,G碱基一定程度上对5端荧光有淬灭作用;3端需进行封闭,以防止在PCR中起引物的作用进行延伸,TAMRA等淬灭剂本身可进行封闭。
●碱基分布
GC含量在30%~80%之间,一条探针中,C含量多于G,G含量高会降低反应效率,这时可选择互补的另一条链作为探针,避免单个核苷酸成串,如GGGGG。
●结合位置
探针退火时,应尽可能接近上游引物,同时又不重叠,离上游引物的3端至少相差一个碱基;如果Taqman探针是用于检测等位基因或突变位点,则应将错配核苷酸放在探针中间,不能放在末端。
●纯化方式
建议选择HPLC纯化。
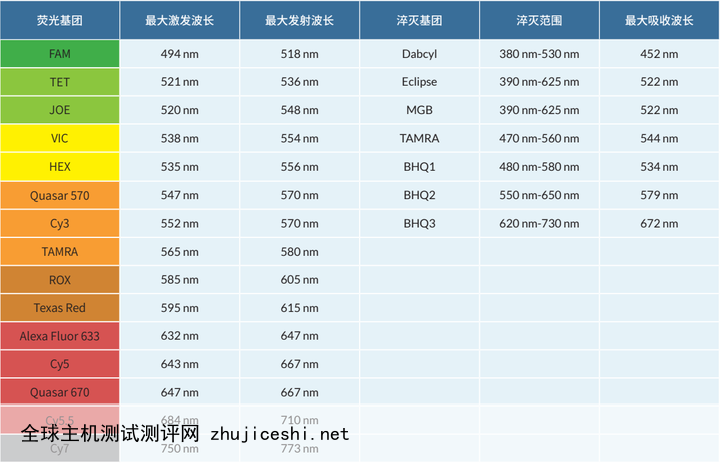
TaqMan探针荧光选择
TaqMan探针保存注意点
TaqMan探针必须避光保存,避免荧光基团降解,干粉可于-80℃保存一年以上,需要取用时可于-20℃保存,若单次合成探针量大,可将探针配制成100 pmol/μL的储备液,留作分批使用,分装成几份于-20 ℃保存。使用前,将配制好的储备液稀释成工作液 (按需稀释,一般为10 pmol/μL),剩余部分于-20 ℃保存,防止反复冻融。













0 留言